QUÍMICA ANALÍTICA II
Em uma aula prática de química, o professor lançou um desafio para os alunos: "qual a concentração molar de uma solução aquosa de NaOH ?". Para resolver esse problema, os alunos procederam a titulação de 50mL dessa solução de NaOH, com uma solução aquosa de H2SO4 0,10 molar, que ao final da titulação (ponto de equivalência), tinha consumido 25 mL do titulante. A concentração molar solução analisada, é:
0,15 mol/L
0,10 mol/L
0,25 mol/L
0,30 mol/L
0,20 mol/L
Por meio de uma titulação determine o volume de solução aquosa de ácido clorídrico (HCl) a 3,65g/L que seria necessário para reagir com 50,0 mL de solução de hidróxido de sódio (NaOH) a 0,1M.
Dados: H=1; O=16; Na=23; Cl=35,5.
50,0 L
0,075 L
0,0137 L
0,02 L
0,05 L
A aspirina (ácido acetilsalicílico, massa molar = 180,16 g/mol), pode ser determinada analiticamente em um laboratório, mediante sua hidrólise com uma quantidade conhecida de um excesso de uma base forte, tal como o NaOH, fervendo-se por 10 minutos e depois titule a base remanescente com um ácido padrão. (1 mol AAS – 2 mol NaOH)
Considerando que uma amostra de 0,2775 g foi originalmente pesada, e que 50,0 mL de uma solução aquosa de NaOH 0,100 mol/L foram usados no procedimento de hidrólise, e que 12,05 mL de uma solução de HCl 0,2000 mol/L foram necessários para titular o excesso de base, usando-se o vermelho de fenol como indicador, qual é a porcentagem aproximada de pureza da amostra?
99%
62%
75%
84 %
50%
Cinqüenta mililitros de uma amostra contendo Ni2+ foram tratados com 25 mL de uma solução 0,0500 M de EDTA para complexar com todo Ni2+ e deixar um excesso de EDTA em solução. O excesso de EDTA foi então titulado de volta, precisando de 5,0 mL de uma solução 0,0500 M de Zn2+ . Qual é a concentração de Ni2+ na solução original?
[Ni2+]= 0,08 mol/L
[Ni2+]= 0,01 mol/L
[Ni2+]= 0,05 mol/L
[Ni2+]= 0,04 mol/L
[Ni2+]= 0,02 mol/L
Pela legislação brasileira, a cachaça deve obedecer ao limite de 5 mg/L, quanto ao teor de cobre. Para saber se tal limite foi obedecido, 5,0 mL de uma certa cachaça foram titulados com solução de sal de sódio do EDTA (ácido etileno diamino tetraacético), 1,0.10–3 mol L–1, gastando-se 4,0 mL na titulação. Sabendo-se que a massa molar do cobre é 63,5 g/mol e que o cobre reage com o EDTA na proporção, em mol, de 1:1, a concentração de cobre nessa cachaça , em mg/L, é, aproximadamente?
500
10
25
5
50
Uma amostra de 50 mL de água oxigenada foi titulada em meio sulfúrico com permanganato de potássio 0,1 M, gastando-se 22,3 mL da solução oxidante. A reação que ocorre é :
2 KmnO4 + 5 H2O2 + 3 H2SO4 à K2SO4 + 2 MnSO4 + 8 H2O + 5 O2 .
Assinale a alternativa que corresponde à concentração em mol/L da solução de água oxigenada.
0,5325 mol/L
0,1564 mol/L
0,5065 mol/L
0,1115 mol/L
0,3498 mol/L
Com a finalidade de fazer uma análise, um aluno propôs a titulação de uma solução de Fe2+ com uma solução de KMnO4 em meio de ácido sulfúrico, a uma temperatura de 25 °C. Considerando as reações de redução abaixo, é verdadeiro afirmar:
MnO4- (aq) + 8 H+ (aq) + 5 e - Mn2+ (aq) + 4 H2O(l) E◦= 1,51 V
Fe3+ (aq) + e - Fe2+ (aq) E◦= 0,77 V
A reação é espontânea com E° = + 1,51 V.
A reação é espontânea com E° = + 0,74 V.
A reação é espontânea com E° = + 2,28 V.
A reação não é espontânea com E° = -2,28 V.
A reação não é espontânea com E° = - 0,74 V.
Calcule a porcentagem de prata (107,8 g.mol-1) numa liga em uma amostra de 0,2025 g. que foi pesada e dissolvida adequadamente. A amostra em solução foi transferida para o erlenmeyer e titulada com uma solução padrão de KSCN 0,1000 mol L-1. Foram gastos 15,25 mL deste padrão para atingir o ponto final da titulação.
79,45 % de Ag
23,81 % de Ag
50,45 % de Ag
81,23 % de Ag
65,32 % de Ag
O ácido iopanóico é muito utilizado como solução oral como contraste radiopaco. Uma amostra 190,32 mg de ácido iopanóico foi tratada com NaOH conforme apresentado na reação a seguir:
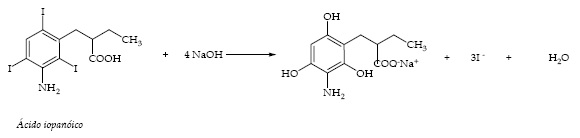
Como pode observar na reação acima o tratamento com NaOH libera 3 mols de iodeto (I-) para cada mol de ácido iopanóico. A seguir, utilizando-se um indicador adequado, procedeu-se a uma titulação do iodeto liberado com AgNO3 0,05 mol/L, gastando-se 20,00 mL para atingir o ponto final da titulação. A partir destas informações, determine o teor (%) de ácido iopanóico presente na amostra. Dado: Ácido Iopanóico: 570,93 g/mol
0,15 mol/L
0,10 mol/L
0,25 mol/L
0,30 mol/L
0,20 mol/L
Por meio de uma titulação determine o volume de solução aquosa de ácido clorídrico (HCl) a 3,65g/L que seria necessário para reagir com 50,0 mL de solução de hidróxido de sódio (NaOH) a 0,1M.
Dados: H=1; O=16; Na=23; Cl=35,5.
50,0 L
0,075 L
0,0137 L
0,02 L
0,05 L
A aspirina (ácido acetilsalicílico, massa molar = 180,16 g/mol), pode ser determinada analiticamente em um laboratório, mediante sua hidrólise com uma quantidade conhecida de um excesso de uma base forte, tal como o NaOH, fervendo-se por 10 minutos e depois titule a base remanescente com um ácido padrão. (1 mol AAS – 2 mol NaOH)
Considerando que uma amostra de 0,2775 g foi originalmente pesada, e que 50,0 mL de uma solução aquosa de NaOH 0,100 mol/L foram usados no procedimento de hidrólise, e que 12,05 mL de uma solução de HCl 0,2000 mol/L foram necessários para titular o excesso de base, usando-se o vermelho de fenol como indicador, qual é a porcentagem aproximada de pureza da amostra?
99%
62%
75%
84 %
50%
Cinqüenta mililitros de uma amostra contendo Ni2+ foram tratados com 25 mL de uma solução 0,0500 M de EDTA para complexar com todo Ni2+ e deixar um excesso de EDTA em solução. O excesso de EDTA foi então titulado de volta, precisando de 5,0 mL de uma solução 0,0500 M de Zn2+ . Qual é a concentração de Ni2+ na solução original?
[Ni2+]= 0,08 mol/L
[Ni2+]= 0,01 mol/L
[Ni2+]= 0,05 mol/L
[Ni2+]= 0,04 mol/L
[Ni2+]= 0,02 mol/L
Pela legislação brasileira, a cachaça deve obedecer ao limite de 5 mg/L, quanto ao teor de cobre. Para saber se tal limite foi obedecido, 5,0 mL de uma certa cachaça foram titulados com solução de sal de sódio do EDTA (ácido etileno diamino tetraacético), 1,0.10–3 mol L–1, gastando-se 4,0 mL na titulação. Sabendo-se que a massa molar do cobre é 63,5 g/mol e que o cobre reage com o EDTA na proporção, em mol, de 1:1, a concentração de cobre nessa cachaça , em mg/L, é, aproximadamente?
500
10
25
5
50
Uma amostra de 50 mL de água oxigenada foi titulada em meio sulfúrico com permanganato de potássio 0,1 M, gastando-se 22,3 mL da solução oxidante. A reação que ocorre é :
2 KmnO4 + 5 H2O2 + 3 H2SO4 à K2SO4 + 2 MnSO4 + 8 H2O + 5 O2 .
Assinale a alternativa que corresponde à concentração em mol/L da solução de água oxigenada.
0,5325 mol/L
0,1564 mol/L
0,5065 mol/L
0,1115 mol/L
0,3498 mol/L
Com a finalidade de fazer uma análise, um aluno propôs a titulação de uma solução de Fe2+ com uma solução de KMnO4 em meio de ácido sulfúrico, a uma temperatura de 25 °C. Considerando as reações de redução abaixo, é verdadeiro afirmar:
MnO4- (aq) + 8 H+ (aq) + 5 e - Mn2+ (aq) + 4 H2O(l) E◦= 1,51 V
Fe3+ (aq) + e - Fe2+ (aq) E◦= 0,77 V
A reação é espontânea com E° = + 1,51 V.
A reação é espontânea com E° = + 0,74 V.
A reação é espontânea com E° = + 2,28 V.
A reação não é espontânea com E° = -2,28 V.
A reação não é espontânea com E° = - 0,74 V.
Calcule a porcentagem de prata (107,8 g.mol-1) numa liga em uma amostra de 0,2025 g. que foi pesada e dissolvida adequadamente. A amostra em solução foi transferida para o erlenmeyer e titulada com uma solução padrão de KSCN 0,1000 mol L-1. Foram gastos 15,25 mL deste padrão para atingir o ponto final da titulação.
79,45 % de Ag
23,81 % de Ag
50,45 % de Ag
81,23 % de Ag
65,32 % de Ag
O ácido iopanóico é muito utilizado como solução oral como contraste radiopaco. Uma amostra 190,32 mg de ácido iopanóico foi tratada com NaOH conforme apresentado na reação a seguir:

Como pode observar na reação acima o tratamento com NaOH libera 3 mols de iodeto (I-) para cada mol de ácido iopanóico. A seguir, utilizando-se um indicador adequado, procedeu-se a uma titulação do iodeto liberado com AgNO3 0,05 mol/L, gastando-se 20,00 mL para atingir o ponto final da titulação. A partir destas informações, determine o teor (%) de ácido iopanóico presente na amostra. Dado: Ácido Iopanóico: 570,93 g/mol
50,0 L
0,075 L
0,0137 L
0,02 L
0,05 L
A aspirina (ácido acetilsalicílico, massa molar = 180,16 g/mol), pode ser determinada analiticamente em um laboratório, mediante sua hidrólise com uma quantidade conhecida de um excesso de uma base forte, tal como o NaOH, fervendo-se por 10 minutos e depois titule a base remanescente com um ácido padrão. (1 mol AAS – 2 mol NaOH)
Considerando que uma amostra de 0,2775 g foi originalmente pesada, e que 50,0 mL de uma solução aquosa de NaOH 0,100 mol/L foram usados no procedimento de hidrólise, e que 12,05 mL de uma solução de HCl 0,2000 mol/L foram necessários para titular o excesso de base, usando-se o vermelho de fenol como indicador, qual é a porcentagem aproximada de pureza da amostra?
99%
62%
75%
84 %
50%
Cinqüenta mililitros de uma amostra contendo Ni2+ foram tratados com 25 mL de uma solução 0,0500 M de EDTA para complexar com todo Ni2+ e deixar um excesso de EDTA em solução. O excesso de EDTA foi então titulado de volta, precisando de 5,0 mL de uma solução 0,0500 M de Zn2+ . Qual é a concentração de Ni2+ na solução original?
[Ni2+]= 0,08 mol/L
[Ni2+]= 0,01 mol/L
[Ni2+]= 0,05 mol/L
[Ni2+]= 0,04 mol/L
[Ni2+]= 0,02 mol/L
Pela legislação brasileira, a cachaça deve obedecer ao limite de 5 mg/L, quanto ao teor de cobre. Para saber se tal limite foi obedecido, 5,0 mL de uma certa cachaça foram titulados com solução de sal de sódio do EDTA (ácido etileno diamino tetraacético), 1,0.10–3 mol L–1, gastando-se 4,0 mL na titulação. Sabendo-se que a massa molar do cobre é 63,5 g/mol e que o cobre reage com o EDTA na proporção, em mol, de 1:1, a concentração de cobre nessa cachaça , em mg/L, é, aproximadamente?
500
10
25
5
50
Uma amostra de 50 mL de água oxigenada foi titulada em meio sulfúrico com permanganato de potássio 0,1 M, gastando-se 22,3 mL da solução oxidante. A reação que ocorre é :
2 KmnO4 + 5 H2O2 + 3 H2SO4 à K2SO4 + 2 MnSO4 + 8 H2O + 5 O2 .
Assinale a alternativa que corresponde à concentração em mol/L da solução de água oxigenada.
0,5325 mol/L
0,1564 mol/L
0,5065 mol/L
0,1115 mol/L
0,3498 mol/L
Com a finalidade de fazer uma análise, um aluno propôs a titulação de uma solução de Fe2+ com uma solução de KMnO4 em meio de ácido sulfúrico, a uma temperatura de 25 °C. Considerando as reações de redução abaixo, é verdadeiro afirmar:
MnO4- (aq) + 8 H+ (aq) + 5 e - Mn2+ (aq) + 4 H2O(l) E◦= 1,51 V
Fe3+ (aq) + e - Fe2+ (aq) E◦= 0,77 V
A reação é espontânea com E° = + 1,51 V.
A reação é espontânea com E° = + 0,74 V.
A reação é espontânea com E° = + 2,28 V.
A reação não é espontânea com E° = -2,28 V.
A reação não é espontânea com E° = - 0,74 V.
Calcule a porcentagem de prata (107,8 g.mol-1) numa liga em uma amostra de 0,2025 g. que foi pesada e dissolvida adequadamente. A amostra em solução foi transferida para o erlenmeyer e titulada com uma solução padrão de KSCN 0,1000 mol L-1. Foram gastos 15,25 mL deste padrão para atingir o ponto final da titulação.
79,45 % de Ag
23,81 % de Ag
50,45 % de Ag
81,23 % de Ag
65,32 % de Ag
O ácido iopanóico é muito utilizado como solução oral como contraste radiopaco. Uma amostra 190,32 mg de ácido iopanóico foi tratada com NaOH conforme apresentado na reação a seguir:

Como pode observar na reação acima o tratamento com NaOH libera 3 mols de iodeto (I-) para cada mol de ácido iopanóico. A seguir, utilizando-se um indicador adequado, procedeu-se a uma titulação do iodeto liberado com AgNO3 0,05 mol/L, gastando-se 20,00 mL para atingir o ponto final da titulação. A partir destas informações, determine o teor (%) de ácido iopanóico presente na amostra. Dado: Ácido Iopanóico: 570,93 g/mol
99%
62%
75%
84 %
50%
Cinqüenta mililitros de uma amostra contendo Ni2+ foram tratados com 25 mL de uma solução 0,0500 M de EDTA para complexar com todo Ni2+ e deixar um excesso de EDTA em solução. O excesso de EDTA foi então titulado de volta, precisando de 5,0 mL de uma solução 0,0500 M de Zn2+ . Qual é a concentração de Ni2+ na solução original?
[Ni2+]= 0,08 mol/L
[Ni2+]= 0,01 mol/L
[Ni2+]= 0,05 mol/L
[Ni2+]= 0,04 mol/L
[Ni2+]= 0,02 mol/L
Pela legislação brasileira, a cachaça deve obedecer ao limite de 5 mg/L, quanto ao teor de cobre. Para saber se tal limite foi obedecido, 5,0 mL de uma certa cachaça foram titulados com solução de sal de sódio do EDTA (ácido etileno diamino tetraacético), 1,0.10–3 mol L–1, gastando-se 4,0 mL na titulação. Sabendo-se que a massa molar do cobre é 63,5 g/mol e que o cobre reage com o EDTA na proporção, em mol, de 1:1, a concentração de cobre nessa cachaça , em mg/L, é, aproximadamente?
500
10
25
5
50
Uma amostra de 50 mL de água oxigenada foi titulada em meio sulfúrico com permanganato de potássio 0,1 M, gastando-se 22,3 mL da solução oxidante. A reação que ocorre é :
2 KmnO4 + 5 H2O2 + 3 H2SO4 à K2SO4 + 2 MnSO4 + 8 H2O + 5 O2 .
Assinale a alternativa que corresponde à concentração em mol/L da solução de água oxigenada.
0,5325 mol/L
0,1564 mol/L
0,5065 mol/L
0,1115 mol/L
0,3498 mol/L
Com a finalidade de fazer uma análise, um aluno propôs a titulação de uma solução de Fe2+ com uma solução de KMnO4 em meio de ácido sulfúrico, a uma temperatura de 25 °C. Considerando as reações de redução abaixo, é verdadeiro afirmar:
MnO4- (aq) + 8 H+ (aq) + 5 e - Mn2+ (aq) + 4 H2O(l) E◦= 1,51 V
Fe3+ (aq) + e - Fe2+ (aq) E◦= 0,77 V
A reação é espontânea com E° = + 1,51 V.
A reação é espontânea com E° = + 0,74 V.
A reação é espontânea com E° = + 2,28 V.
A reação não é espontânea com E° = -2,28 V.
A reação não é espontânea com E° = - 0,74 V.
Calcule a porcentagem de prata (107,8 g.mol-1) numa liga em uma amostra de 0,2025 g. que foi pesada e dissolvida adequadamente. A amostra em solução foi transferida para o erlenmeyer e titulada com uma solução padrão de KSCN 0,1000 mol L-1. Foram gastos 15,25 mL deste padrão para atingir o ponto final da titulação.
79,45 % de Ag
23,81 % de Ag
50,45 % de Ag
81,23 % de Ag
65,32 % de Ag
O ácido iopanóico é muito utilizado como solução oral como contraste radiopaco. Uma amostra 190,32 mg de ácido iopanóico foi tratada com NaOH conforme apresentado na reação a seguir:

Como pode observar na reação acima o tratamento com NaOH libera 3 mols de iodeto (I-) para cada mol de ácido iopanóico. A seguir, utilizando-se um indicador adequado, procedeu-se a uma titulação do iodeto liberado com AgNO3 0,05 mol/L, gastando-se 20,00 mL para atingir o ponto final da titulação. A partir destas informações, determine o teor (%) de ácido iopanóico presente na amostra. Dado: Ácido Iopanóico: 570,93 g/mol
[Ni2+]= 0,08 mol/L
[Ni2+]= 0,01 mol/L
[Ni2+]= 0,05 mol/L
[Ni2+]= 0,04 mol/L
[Ni2+]= 0,02 mol/L
Pela legislação brasileira, a cachaça deve obedecer ao limite de 5 mg/L, quanto ao teor de cobre. Para saber se tal limite foi obedecido, 5,0 mL de uma certa cachaça foram titulados com solução de sal de sódio do EDTA (ácido etileno diamino tetraacético), 1,0.10–3 mol L–1, gastando-se 4,0 mL na titulação. Sabendo-se que a massa molar do cobre é 63,5 g/mol e que o cobre reage com o EDTA na proporção, em mol, de 1:1, a concentração de cobre nessa cachaça , em mg/L, é, aproximadamente?
500
10
25
5
50
Uma amostra de 50 mL de água oxigenada foi titulada em meio sulfúrico com permanganato de potássio 0,1 M, gastando-se 22,3 mL da solução oxidante. A reação que ocorre é :
2 KmnO4 + 5 H2O2 + 3 H2SO4 à K2SO4 + 2 MnSO4 + 8 H2O + 5 O2 .
Assinale a alternativa que corresponde à concentração em mol/L da solução de água oxigenada.
0,5325 mol/L
0,1564 mol/L
0,5065 mol/L
0,1115 mol/L
0,3498 mol/L
Com a finalidade de fazer uma análise, um aluno propôs a titulação de uma solução de Fe2+ com uma solução de KMnO4 em meio de ácido sulfúrico, a uma temperatura de 25 °C. Considerando as reações de redução abaixo, é verdadeiro afirmar:
MnO4- (aq) + 8 H+ (aq) + 5 e - Mn2+ (aq) + 4 H2O(l) E◦= 1,51 V
Fe3+ (aq) + e - Fe2+ (aq) E◦= 0,77 V
A reação é espontânea com E° = + 1,51 V.
A reação é espontânea com E° = + 0,74 V.
A reação é espontânea com E° = + 2,28 V.
A reação não é espontânea com E° = -2,28 V.
A reação não é espontânea com E° = - 0,74 V.
Calcule a porcentagem de prata (107,8 g.mol-1) numa liga em uma amostra de 0,2025 g. que foi pesada e dissolvida adequadamente. A amostra em solução foi transferida para o erlenmeyer e titulada com uma solução padrão de KSCN 0,1000 mol L-1. Foram gastos 15,25 mL deste padrão para atingir o ponto final da titulação.
79,45 % de Ag
23,81 % de Ag
50,45 % de Ag
81,23 % de Ag
65,32 % de Ag
O ácido iopanóico é muito utilizado como solução oral como contraste radiopaco. Uma amostra 190,32 mg de ácido iopanóico foi tratada com NaOH conforme apresentado na reação a seguir:

Como pode observar na reação acima o tratamento com NaOH libera 3 mols de iodeto (I-) para cada mol de ácido iopanóico. A seguir, utilizando-se um indicador adequado, procedeu-se a uma titulação do iodeto liberado com AgNO3 0,05 mol/L, gastando-se 20,00 mL para atingir o ponto final da titulação. A partir destas informações, determine o teor (%) de ácido iopanóico presente na amostra. Dado: Ácido Iopanóico: 570,93 g/mol
500
10
25
5
50
Uma amostra de 50 mL de água oxigenada foi titulada em meio sulfúrico com permanganato de potássio 0,1 M, gastando-se 22,3 mL da solução oxidante. A reação que ocorre é :
2 KmnO4 + 5 H2O2 + 3 H2SO4 à K2SO4 + 2 MnSO4 + 8 H2O + 5 O2 .
Assinale a alternativa que corresponde à concentração em mol/L da solução de água oxigenada.
0,5325 mol/L
0,1564 mol/L
0,5065 mol/L
0,1115 mol/L
0,3498 mol/L
Com a finalidade de fazer uma análise, um aluno propôs a titulação de uma solução de Fe2+ com uma solução de KMnO4 em meio de ácido sulfúrico, a uma temperatura de 25 °C. Considerando as reações de redução abaixo, é verdadeiro afirmar:
MnO4- (aq) + 8 H+ (aq) + 5 e - Mn2+ (aq) + 4 H2O(l) E◦= 1,51 V
Fe3+ (aq) + e - Fe2+ (aq) E◦= 0,77 V
A reação é espontânea com E° = + 1,51 V.
A reação é espontânea com E° = + 0,74 V.
A reação é espontânea com E° = + 2,28 V.
A reação não é espontânea com E° = -2,28 V.
A reação não é espontânea com E° = - 0,74 V.
Calcule a porcentagem de prata (107,8 g.mol-1) numa liga em uma amostra de 0,2025 g. que foi pesada e dissolvida adequadamente. A amostra em solução foi transferida para o erlenmeyer e titulada com uma solução padrão de KSCN 0,1000 mol L-1. Foram gastos 15,25 mL deste padrão para atingir o ponto final da titulação.
79,45 % de Ag
23,81 % de Ag
50,45 % de Ag
81,23 % de Ag
65,32 % de Ag
O ácido iopanóico é muito utilizado como solução oral como contraste radiopaco. Uma amostra 190,32 mg de ácido iopanóico foi tratada com NaOH conforme apresentado na reação a seguir:

Como pode observar na reação acima o tratamento com NaOH libera 3 mols de iodeto (I-) para cada mol de ácido iopanóico. A seguir, utilizando-se um indicador adequado, procedeu-se a uma titulação do iodeto liberado com AgNO3 0,05 mol/L, gastando-se 20,00 mL para atingir o ponto final da titulação. A partir destas informações, determine o teor (%) de ácido iopanóico presente na amostra. Dado: Ácido Iopanóico: 570,93 g/mol
0,5325 mol/L
0,1564 mol/L
0,5065 mol/L
0,1115 mol/L
0,3498 mol/L
Com a finalidade de fazer uma análise, um aluno propôs a titulação de uma solução de Fe2+ com uma solução de KMnO4 em meio de ácido sulfúrico, a uma temperatura de 25 °C. Considerando as reações de redução abaixo, é verdadeiro afirmar:
MnO4- (aq) + 8 H+ (aq) + 5 e - Mn2+ (aq) + 4 H2O(l) E◦= 1,51 V
Fe3+ (aq) + e - Fe2+ (aq) E◦= 0,77 V
A reação é espontânea com E° = + 1,51 V.
A reação é espontânea com E° = + 0,74 V.
A reação é espontânea com E° = + 2,28 V.
A reação não é espontânea com E° = -2,28 V.
A reação não é espontânea com E° = - 0,74 V.
Calcule a porcentagem de prata (107,8 g.mol-1) numa liga em uma amostra de 0,2025 g. que foi pesada e dissolvida adequadamente. A amostra em solução foi transferida para o erlenmeyer e titulada com uma solução padrão de KSCN 0,1000 mol L-1. Foram gastos 15,25 mL deste padrão para atingir o ponto final da titulação.
79,45 % de Ag
23,81 % de Ag
50,45 % de Ag
81,23 % de Ag
65,32 % de Ag
O ácido iopanóico é muito utilizado como solução oral como contraste radiopaco. Uma amostra 190,32 mg de ácido iopanóico foi tratada com NaOH conforme apresentado na reação a seguir:

Como pode observar na reação acima o tratamento com NaOH libera 3 mols de iodeto (I-) para cada mol de ácido iopanóico. A seguir, utilizando-se um indicador adequado, procedeu-se a uma titulação do iodeto liberado com AgNO3 0,05 mol/L, gastando-se 20,00 mL para atingir o ponto final da titulação. A partir destas informações, determine o teor (%) de ácido iopanóico presente na amostra. Dado: Ácido Iopanóico: 570,93 g/mol
A reação é espontânea com E° = + 1,51 V.
A reação é espontânea com E° = + 0,74 V.
A reação é espontânea com E° = + 2,28 V.
A reação não é espontânea com E° = -2,28 V.
A reação não é espontânea com E° = - 0,74 V.
Calcule a porcentagem de prata (107,8 g.mol-1) numa liga em uma amostra de 0,2025 g. que foi pesada e dissolvida adequadamente. A amostra em solução foi transferida para o erlenmeyer e titulada com uma solução padrão de KSCN 0,1000 mol L-1. Foram gastos 15,25 mL deste padrão para atingir o ponto final da titulação.
79,45 % de Ag
23,81 % de Ag
50,45 % de Ag
81,23 % de Ag
65,32 % de Ag
O ácido iopanóico é muito utilizado como solução oral como contraste radiopaco. Uma amostra 190,32 mg de ácido iopanóico foi tratada com NaOH conforme apresentado na reação a seguir:

Como pode observar na reação acima o tratamento com NaOH libera 3 mols de iodeto (I-) para cada mol de ácido iopanóico. A seguir, utilizando-se um indicador adequado, procedeu-se a uma titulação do iodeto liberado com AgNO3 0,05 mol/L, gastando-se 20,00 mL para atingir o ponto final da titulação. A partir destas informações, determine o teor (%) de ácido iopanóico presente na amostra. Dado: Ácido Iopanóico: 570,93 g/mol
79,45 % de Ag
23,81 % de Ag
50,45 % de Ag
81,23 % de Ag
65,32 % de Ag
O ácido iopanóico é muito utilizado como solução oral como contraste radiopaco. Uma amostra 190,32 mg de ácido iopanóico foi tratada com NaOH conforme apresentado na reação a seguir:

Como pode observar na reação acima o tratamento com NaOH libera 3 mols de iodeto (I-) para cada mol de ácido iopanóico. A seguir, utilizando-se um indicador adequado, procedeu-se a uma titulação do iodeto liberado com AgNO3 0,05 mol/L, gastando-se 20,00 mL para atingir o ponto final da titulação. A partir destas informações, determine o teor (%) de ácido iopanóico presente na amostra. Dado: Ácido Iopanóico: 570,93 g/mol
